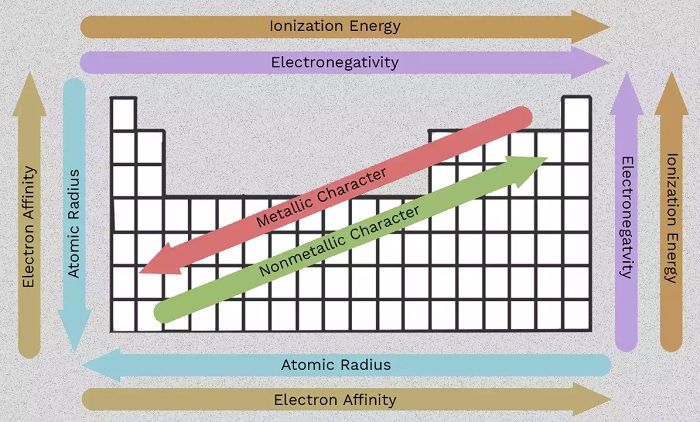
Sử dụng biểu đồ này để xem nhanh xu hướng bảng tuần hoàn về độ âm điện, năng lượng ion hóa, bán kính nguyên tử, tính chất kim loại và ái lực điện tử. Các nguyên tố được nhóm lại theo cấu trúc electron tương tự nhau, điều này làm cho các đặc tính của nguyên tố định kỳ này dễ dàng được hiển thị trong bảng tuần hoàn.
Độ âm điện
Độ âm điện phản ánh mức độ dễ dàng của một nguyên tử có thể hình thành liên kết hóa học. Nói chung, độ âm điện tăng dần từ trái sang phải và giảm khi bạn di chuyển xuống một nhóm. Hãy nhớ rằng, các khí hiếm (cột ngoài cùng bên phải của bảng) tương đối trơ, do đó độ âm điện của chúng tiến gần đến 0 (tách khỏi xu hướng chung). Sự chênh lệc giữa các giá trị độ âm điện càng lớn thì hai nguyên tử càng có nhiều khả năng hình thành liên kết hóa học.
Tính kim loại
Hầu hết các nguyên tố trong bảng tuần hoàn đều là kim loại, có nghĩa là chúng có đặc tính kim loại. Các đặc tính của kim loại bao gồm độ bóng kim loại, độ dẫn điện và nhiệt cao, độ dẻo, dễ kéo sợi và một số đặc điểm khác. Phía bên phải của bảng tuần hoàn chứa các phi kim, không hiển thị các đặc tính này. Cũng như các tính chất khác, tính kim loại liên quan đến cấu hình của các electron hóa trị.
Ái lực điện tử
Ái lực điện tử là mức độ dễ dàng mà một nguyên tử chấp nhận một electron. Ái lực điện tử giảm khi di chuyển xuống cột và tăng khi di chuyển từ trái sang phải trên một hàng của bảng tuần hoàn. Giá trị được trích dẫn cho ái lực điện tử của nguyên tử là năng lượng thu được khi thêm một electron hoặc năng lượng bị mất khi một electron bị loại bỏ khỏi anion tích điện đơn. Điều này phụ thuộc vào cấu hình của lớp vỏ electron bên ngoài, do đó các nguyên tố trong một nhóm có ái lực điện tử tương tự nhau (dương hoặc âm). Như bạn có thể mong đợi, các nguyên tố tạo thành anion ít có khả năng hút electron hơn các nguyên tố tạo thành cation. Các nguyên tố khí hiếm có ái lực điện tử gần bằng 0.
Năng lượng ion hóa
Năng lượng ion hóa là lượng năn lượng nhỏ nhất cần thiết để kéo một electron ra khỏi nguyên tử ở trạng thái khí. Năng lượng ion hóa tăng lên khi bạn di chuyển trong một chu kỳ (từ trái sang phải) vì số lượng proton ngày càng thu hút các electron mạnh hơn, khiến việc loại bỏ một electron trở nên khó khăn hơn.
Khi bạn đi xuống một nhóm (từ trên xuống dưới), năng lượng ion hóa giảm do có thêm một lớp vỏ electron, di chuyển electron ngoài cùng ra xa hạt nhân nguyên tử.
Bán kính nguyên tử
Bán kính nguyên tử là khoảng cách từ hạt nhân đến electron ổn định ngoài cùng trong khi bán kính ion bằng một nửa khoảng cách giữa hai hạt nhân nguyên tử vừa chạm vào nhau. Những giá trị liên quan này hiển thị cùng một xu hướng trong bảng tuần hoàn.
Khi bạn di chuyển xuống bảng tuần hoàn, các nguyên tố có nhiều proton hơn và có thêm một lớp vỏ năng lượng electron, do đó các nguyên tử trở nên lớn hơn. Khi bạn di chuyển qua một hàng của bảng tuần hoàn, có nhiều proton và electron hơn, nhưng các electron được hút gần hạt nhân hơn, do đó kích thước tổng thể của nguyên tử giảm đi.
Bài viết liên quan:



Any comments?